氯吡格雷和普拉格雷均为前体药物,经生物转化为活性代谢产物。多项研究已证实,CYP2C19等位基因功能缺失与对氯吡格雷的药理学反应和临床反应有关。最近,一项研究提出,在二乙基对硝基苯磷酸酯酶基因(PON1)中,功能基因突变(Q192R rs662)显著增强氯吡格雷的生物转化。
■ 基因变异与普拉格雷的反应性
氯吡格雷和普拉格雷均为前体药物,经生物转化为活性代谢产物。多项研究已证实,CYP2C19等位基因功能缺失与对氯吡格雷的药理学反应和临床反应有关。最近,一项研究提出,在二乙基对硝基苯磷酸酯酶基因(PON1)中,功能基因突变(Q192R rs662)显著增强氯吡格雷的生物转化。
Jessica L Mega(Brigham and Women’s Hosp, Boston)等复制氯吡格雷的这种相关性,评估其对普拉格雷的影响。他们对275例使用氯吡格雷或普拉格雷治疗的健康者进行PON1 rs662基因分型,并检验活性药物代谢产物的血浆浓度与最大的血小板聚集的变化之间的相关性。同时,对TRITON-TIMI 38试验中2922例使用氯吡格雷或普拉格雷治疗的急性冠状动脉综合征(ACS)患者也进行这种突变基因的基因分型。结果显示,健康者中,rs662的基因型分别为:37% A/A,45% A/G和 18% G/G。与以往的发现相反,在氯吡格雷治疗(负荷量「LD」或维持量「MD」)的健康者中,rs662与活性药物代谢产物的血浆浓度(P=0.62)和血小板聚集的变化(P=0.51)均无显著相关性;与此相似,普拉格雷治疗(LD或MD)的健康者中,rs662与活性药物代谢产物的血浆浓度(P=0.88)和血小板聚集的变化(P=0.97)也无显著相关性。TRITON-TIMI 38试验中,对于氯吡格雷(P=0.66)或普拉格雷(P=0.72)治疗的患者,rs662基因突变与心血管预后无显著相关性。因此,PON1中Q192R (rs662)基因突变与对氯吡格雷的药理学反应无关,与普拉格雷的反应也无关。
■ 普拉格雷降低血小板反应性
PCI后常规给予双联抗血小板治疗,但血小板功能检测确定为对噻吩并吡啶类药物治疗反应差与支架血栓形成(ST)和其他缺血事件的风险增加显著相关。为强化抗血小板治疗,患者可给予加倍剂量的负荷氯吡格雷,随后增加其维持剂量至150 mg/d,或转换为普拉格雷。
Fabian Schmidtler(Heart-Ctr Munich Bogenhausen, München, Germany)等采用多极血小板聚集试验,检测行PCI的1028例患者的血小板功能。初始对氯吡格雷600 mg LD/75mg MD低反应的患者随即分配至氯吡格雷再负荷组(组Ⅰ,n=64,氯吡格雷600 mg LD,150 mg MD)或普拉格雷组(组Ⅱ,n=40,普拉格雷60 mg LD,10 mg MD),回顾性分析两组患者的血小板功能,截断值>42 U定义为低反应(LR),<19 U定义为高反应(HR)。结果显示,组Ⅰ氯吡格雷再负荷前血小板聚集作用为56±18 U,再负荷并调整治疗后为39±19 U,仍有22(34%)例患者出现氯吡格雷LR,仅有4(6%)例完全符合氯吡格雷HR;组Ⅱ在转换为普拉格雷前血小板聚集作用为64±18 U,转换为普拉格雷后为29±17 U,6(15%)例患者在普拉格雷治疗的情况下出现LR,13(32%)例对普拉格雷治疗表现为HR。在标准剂量氯吡格雷低反应者中,与增加氯吡格雷剂量相比,普拉格雷在达到充分的血小板抑制方面明显更加有效(平均血小板聚集降低54% vs. 31%)。
■ 普拉格雷减少支架血栓形成
导致ST的危险因素分为3个方面:支架相关的因素(如DES)、患者/病变相关的因素(如糖尿病、病变长度)和操作相关的因素(如多个支架)。纳入6项研究包括3059例患者的荟萃分析表明,PCI后2年,血小板高反应性(HPR)(PRU≥230)与ST发生率增加相关(HR 2.5「1.31~4.79」;P=0.005)。
TRITON-TIMI 38试验对所有支架的分析表明,与氯吡格雷组(300 mg LD/75 mg MD)相比,普拉格雷组(60 mg LD/10 mg MD)早期(30 天)和晚期(15 个月)确定的/可能的ST的风险降低59%(0.64% vs. 1.56%,HR 0.41「0.29~0.59」;P<0.0001)和40%(0.49% vs. 0.82%,HR 0.60「0.37~0.97」;P=0.03)。TRITON-TIMI 38研究的亚组分析显示,对于既往有心肌梗死(MI)的高危患者,与氯吡格雷相比,普拉格雷治疗可显著降低15个月时确定的/可能的ST的风险达75%(0.8% vs. 3.4%,交互P=0.047);在普拉格雷组,CYP2Y19等位基因功能缺失对确定的/可能的ST的发生率无影响(非携带者1.0% vs. 携带者0.5%)。
纳入3项RCCT(DISPERSE、PLATO和TRITON-TIMI 38)、包括32 893例患者、比较普拉格雷、替卡格雷和氯吡格雷的荟萃分析显示,普拉格雷/替卡格雷在减少ST上优于氯吡格雷(图1),同时,普拉格雷在减少ST上优于替卡格雷(图2)。在STEMI队列中,与氯吡格雷相比,普拉格雷降低确定的/可能的ST的风险达42%(1.6% vs. 2.8%,HR 0.58「0.36~0.93」;P=0.02),替卡格雷为26%(2.6% vs. 3.4%,HR 0.74「0.55~1.00」;P=0.05)。
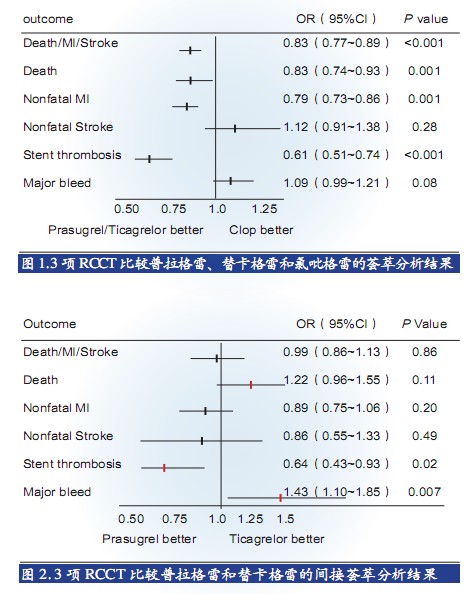
■ 普拉格雷优化治疗结局
在氯吡格雷时代,治疗后血小板反应性与PCI后主要不利心血管事件(MACE)相关。普拉格雷是新型P2Y12 ADP受体拮抗剂,起效更快,有与氯吡格雷相似的活性代谢产物,可产生较强的血小板反应性抑制作用(PRI),改善血栓患者的结局。然而,过度的PRI与出血率增加相关。最新研究显示,血栓形成与出血之间的PRI治疗窗估计为10%~50%。
L. Bonello Laurent(hopital universitaire nord, Marseille, France)等研究了ACS-PCI患者在普拉格雷LD后,PRI能否预测其30天的结局。这项多中心、前瞻性的观察研究纳入301例因ACS成功行PCI并接受普拉格雷治疗的患者,其中,128(42.5%)例为ST段抬高心肌梗死(STEMI)患者,70(23.3%)例为糖尿病患者。在普拉格雷LD后,测定血管舒张因子刺激磷蛋白(VASP)指数,VASP≥50%定义为HTPR。结果显示,普拉格雷负荷后平均VASP指数为34.3%±23.1%,76(25.2%)例患者发现有治疗中血小板高反应性(HTPR),74.8%的患者被认为达到最佳的PRI,33.6%的患者VASP指数<20%。与无事件的患者相比,PCI后经历血栓事件的患者VASP指数显著升高(64.4%±14.4% vs. 33.4%±22.7%,P=0.001);1个月时,有轻微出血或非CABG相关的大出血患者与无出血患者之间VASP指数无差异(30.0%±17.8% vs. 34.3%±23.0%,P=0.7)。Kaplan-Meier分析比较了良好反应者与HTPR患者,证实HTPR患者MACE(心血管「CV」死亡、MI和确定的ST)发生率高。预测血栓事件的最佳VASP指数的截断值为53.5%,其敏感性为87.5%,特异性为76.5%。普拉格雷治疗的情况下,PRI能预测30天时的血栓事件,VASP指数<50%与血栓事件的发生率低相关。对于ACS-PCI患者来说,PRI是预防血栓事件的关键,达到PRI的阈值可预防血栓事件。因此,基于血小板反应性检测优化治疗的策略在限制出血的同时可能减少血栓事件。
■ 出血事件对普拉格雷依从性的影响
Guido Parodi(Careggi Hospital, Invasive Cardiology, Florence, Italy)等连续性入选298例置入支架且使用普拉格雷的患者(年龄68±10岁,31%≥75岁)。普拉格雷治疗的适应证为:⑴STEMI(41%),⑵糖尿病置入DES(6%),⑶ST(3%),⑷左主干病变置入DES(6%),⑸有氯吡格雷治疗中血小板高反应性(HCPR)的ACS或DES置入(26%)。所有患者接受普拉格雷60 mg LD,年龄≥75岁和体重≤60 kg的患者给予普拉格雷5 mg/d MD,其他患者普拉格雷10 mg/d MD。结果显示,入选患者大出血、轻微出血和极少量出血的发生率分别为2.7%、4.7%和15.1%,最常见的出血事件为鼻出血。仅有8(2.7%)例患者长期停用普拉格雷治疗:4例因为出血事件,2例可能因为副反应,2例可能因为与出血或副反应无关的内科决策;14(4.7%)例患者主要因为需要接受外科手术而暂停普拉格雷,平均6.5 天。无1例患者发生确定的或可能的ST,然而,3例患者发生MI,1例发生缺血性卒中。有11例患者死亡:9例因为心力衰竭(HF)或难治性心源性休克,1例因为肺栓塞,1例因为癌症。临床实践中,普拉格雷治疗大出血和轻微出血事件的发生率与随机化对照试验中报道的相当,极少量出血的发生率较高,但不影响治疗的依从性。
■ 小结
ACS-PCI患者的抗血小板治疗一直是心血管领域的研究热点。2011年TCT大会和AHA大会上发布众多关于普拉格雷的研究,这些最新研究的结果显示,普拉格雷能降低血小板反应性,减少支架血栓形成,减少事件发生,改善患者预后,从而,进一步奠定其在临床使用中的地位。



 京公网安备 11010502033353号
京公网安备 11010502033353号