既往双联抗血小板治疗仅有一个选择即阿司匹林+氯吡格雷,经过10年的学术探索和临床实践后,逐步发现氯吡格雷的不足。最近,《药理学》杂志上发表一篇文章,在行经皮冠状动脉介入治疗(PCI)的中国患者中,研究氯吡格雷治疗的抗血小板效应。结果表明,氯吡格雷抗血小板的有效性存在广泛的个体变异,其无应答性与早期复发性心血管(CV)事件风险增加相关。因此,临床上需要抗血小板作用更强且安全的药物。近年来,新型抗血小板药物普拉格雷的疗效和安全性得到广泛的临床认可,继2011年ACC/AHA不稳定型心绞痛/非ST段抬高心肌梗死(UA/NSTEMI)指南首次引入普拉格雷后,2011年ESC非ST段抬高急性冠状动脉综合征(NSTE-ACS)指南再次将普拉格雷推荐为NSTE-ACS患者PCI术后抗血小板治疗的一线用药。普拉格雷是目前除了氯吡格雷和阿司匹林之外唯一获得双指南推荐的药物。
普拉格雷的优势
血小板活化和聚集在动脉血栓形成中占主导地位,是冠状动脉综合征(ACS)治疗的关键靶点。一旦确诊为ACS,就应尽早给予抗血小板治疗,以减少急性缺血并发症和复发性动脉粥样硬化血栓形成事件。与血小板P2Y12受体结合的ADP在血小板活化和聚集过程中起重要作用, 因此,P2Y12受体拮抗剂在ACS中是主要的治疗药物。噻吩并吡啶前体药物如氯吡格雷和普拉格雷经生物转化为与P2Y12受体可逆结合的分子,从而拮抗ADP的信号通路和血小板的活化。
作为第三代P2Y12受体拮抗剂,与二代P2Y12受体拮抗剂氯吡格雷相比,普拉格雷在体内可以通过血浆酯酶代谢,同时在肝脏由CYP酶介导两条代谢途径,这样的双代谢可以使普拉格雷在体内更快速地发挥作用,同时保证了普拉格雷能有更高比例的活性代谢产物转换率,从而使得普拉格雷能产生更快、更强效的血小板抑制作用。另外,与二代氯吡格雷不同的是,普拉格雷的反应性不受CYP抑制剂(包括质子泵抑制剂)、P2Y12基因功能缺失突变和ABCB1功能降低的影响,从而达到“可预期”的治疗效果。
普拉格雷的循证医学证据
TRITON-TIMI 38试验在13 608例拟行PCI的ACS患者中比较普拉格雷(60 mg负荷量,10 mg Qd)与氯吡格雷(300 mg负荷量,75 mg Qd),排除保守治疗的NSTE-ACS患者,但若 NSTE-ACS患者在72 h内有缺血症状、TIMI风险评分≥3分、ST段下移≥1 mm或心脏生化标志物升高仍可入选。结果显示,与氯吡格雷组相比,普拉格雷组主要复合终点(CV死亡、非致死性心肌梗死「MI」或卒中)发生率降低(9.3% vs. 11.2%,HR 0.82;95%CI:0.73~0.93,P=0.002),这主要是由于MI风险显著降低所致(从9.2%降至7.1%,RRR 23.9%;95%CI:12.7~33.7,P<0.001),非致死性MI发生率或CV死亡率无差异。在整个队列中,普拉格雷组明确或可能的支架血栓形成的发生率显著低于氯吡格雷组(1.1% vs. 2.4%, HR 0.48;95%CI:0.36~0.64,P<0.001),但其非CABG相关的TIMI大出血增加(2.4% vs. 1.8%,HR 1.32;95%CI:1.03~1.68,P=0.03),这主要是由于自发性出血(1.6% vs. 1.1%,HR 1.51;95%CI:1.09~2.08,P=0.01)而非动脉穿刺路径相关的出血(0.7% vs. 0.6%,HR 1.18;95%CI:0.77~1.82,P=0.45)增加所致。TRITON研究中,普拉格雷其他不良反应的发生率与氯吡格雷相似,两者血小板减少症的发生率均较低为0.3%,而中性粒细胞减少在普拉格雷中更少见。
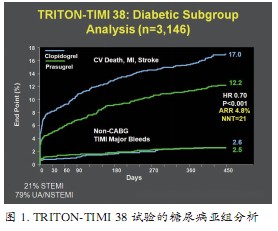
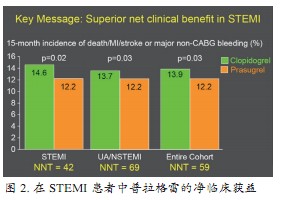
TRITON-TIMI 38研究对多个亚组进行分析,结果显示,与氯吡格雷相比,普拉格雷在联用(6.5% vs. 8.5%,HR 0.76;95%CI:0.64~0.90)或未联用(4.8% vs. 6.1%,HR 0.78;95%CI:0.63~0.97)GPⅡb/Ⅲa受体拮抗剂时死亡、MI或卒中发生率均较低;普拉格雷在合并(肌酐清除率>60 ml/min)或未合并(肌酐清除率<60 ml/min)肾功能损害患者中的疗效无差异;对于合并糖尿病的ACS患者,普拉格雷在降低复合终点上优于氯吡格雷,且不增加大出血风险(图1);对于ST段抬高心肌梗死(STEMI)患者,15个月时普拉格雷死亡/MI/卒中或非CABG大出血发生率低于氯吡格雷(12.2% vs. 14.6%,P=0.02,NNT=42),在STEMI患者中普拉格雷的净临床获益优于氯吡格雷(图2)。
OPTMUS-3试验是一项前瞻性随机双盲交叉研究,在合并2型糖尿病的冠状动脉疾病(CAD)患者中比较普拉格雷与高剂量氯吡格雷的药效学。结果显示,对于合并2型糖尿病的CAD患者,标准剂量的普拉格雷(60 mg负荷量,10 mg维持量)在负荷期和维持期抑制血小板的作用和对血小板的反应性均优于双倍剂量的氯吡格雷(600 mg负荷量,150 mg维持量)。
指南对普拉格雷的更新推荐
NSTE-ACS是一种冠状动脉不稳定的状态,易于再发缺血事件和其他并发症,可导致患者死亡或在短期和长期发生MI,因此,对患者进行危险分层,选择最佳的治疗方案,从而改善预后显得尤为重要。2011ESC NSTE-ACS指南推荐,如无危及生命的高危出血风险或禁忌证,普拉格雷(首次60 mg负荷量,次日始10 mg Qd)应用于冠状动脉病变明确拟行PCI治疗的患者(Ⅰ类推荐,B级证据)。
糖尿病是NSTE-ACS患者死亡的独立预测因素,也是NSTE-ACS危险分层中重要的临床风险评估因素之一,如ESC指南中的TIMI预后风险评分以及CRUSADE出血风险评分将糖尿病纳入其中。与非糖尿病患者相比,糖尿病患者血小板活性增加,对氯吡格雷的反应性降低。注册研究已表明,合并糖尿病的NSTE-ACS患者在短期和长期发生CV事件的风险较高,需要积极的药物治疗和介入治疗。对于合并糖尿病的NSTE-ACS患者,2011ESC NSTE-ACS指南推荐置入药物洗脱支架(DES),以减少反复血运重建率(Ⅰ类推荐,A级证据)。同时,指南提到,与氯吡格雷相比,普拉格雷是一种更强效的血小板抑制剂,能显著降低发生缺血事件的风险,尤其是在糖尿病患者中。
NSTE-ACS患者中有30%~40%存在肾功能不全,这类患者易于发生心力衰竭,且胸痛症状不典型。在NSTE-ACS患者中,慢性肾脏疾病(CKD)与不良预后相关,是短期和长期死亡以及大出血的独立预测因素。鉴于TRITON-TIMI 38研究的亚组分析结果,对于合并CKD的NSTE-ACS患者,2011ESC NSTE-ACS指南在抗栓药物的推荐中认为,在使用普拉格雷时,无需调整剂量,包括终末期患者。



 京公网安备 11010502033353号
京公网安备 11010502033353号